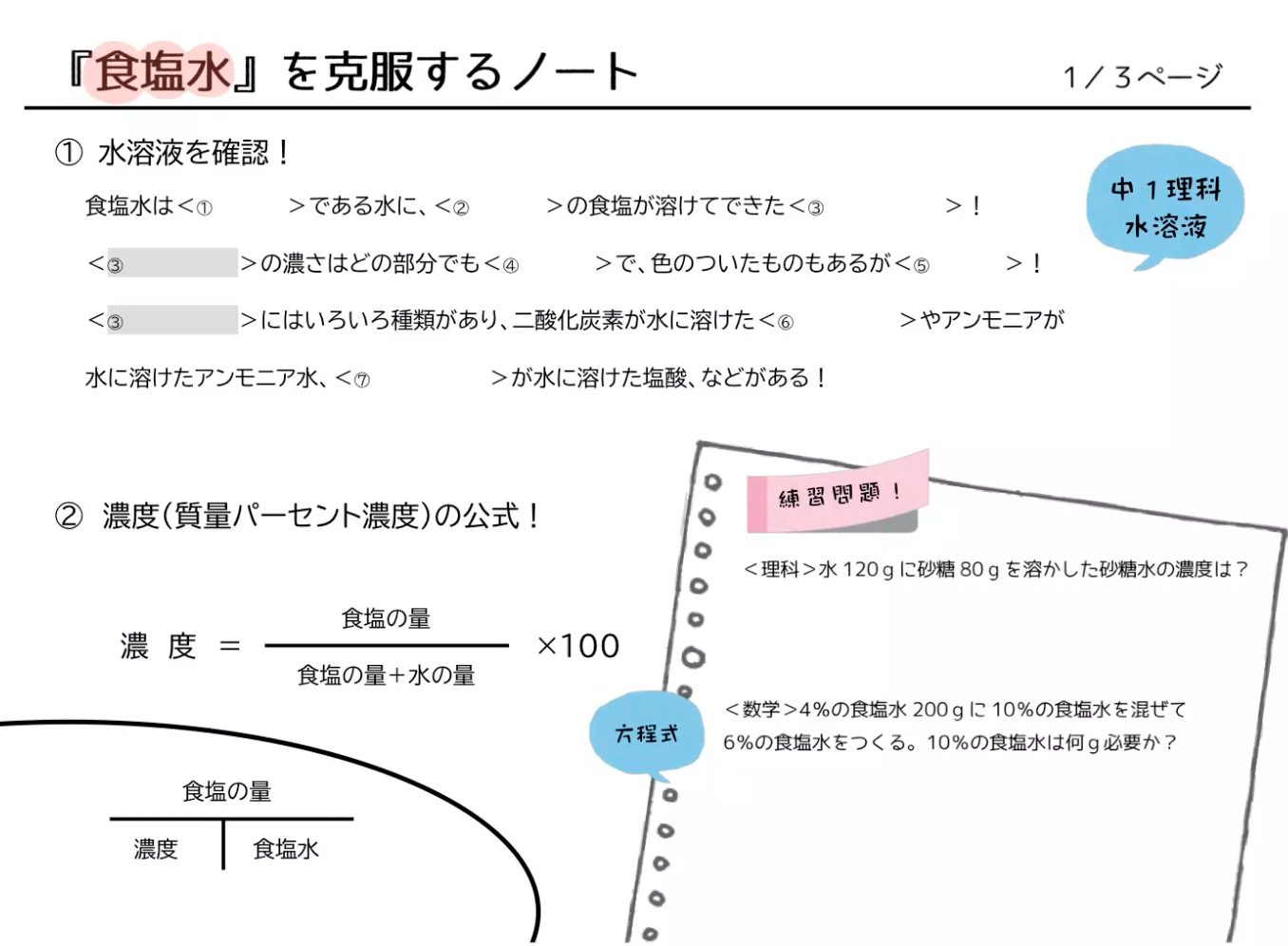
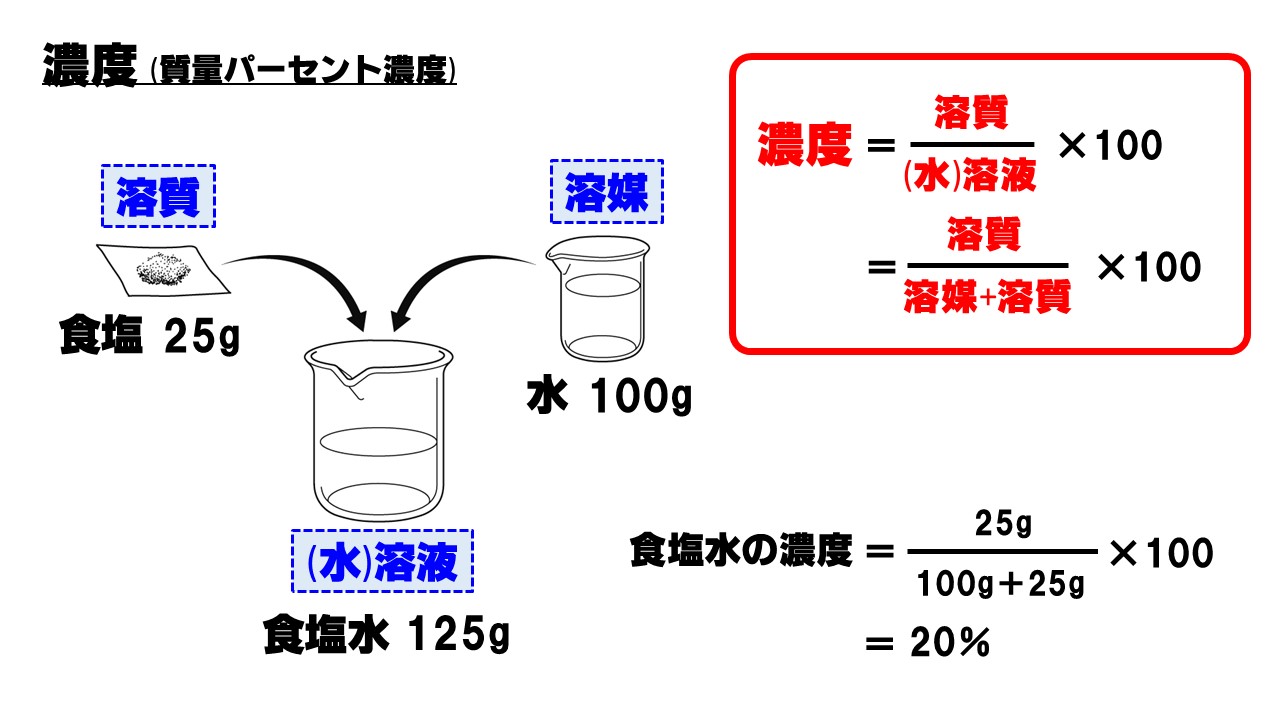
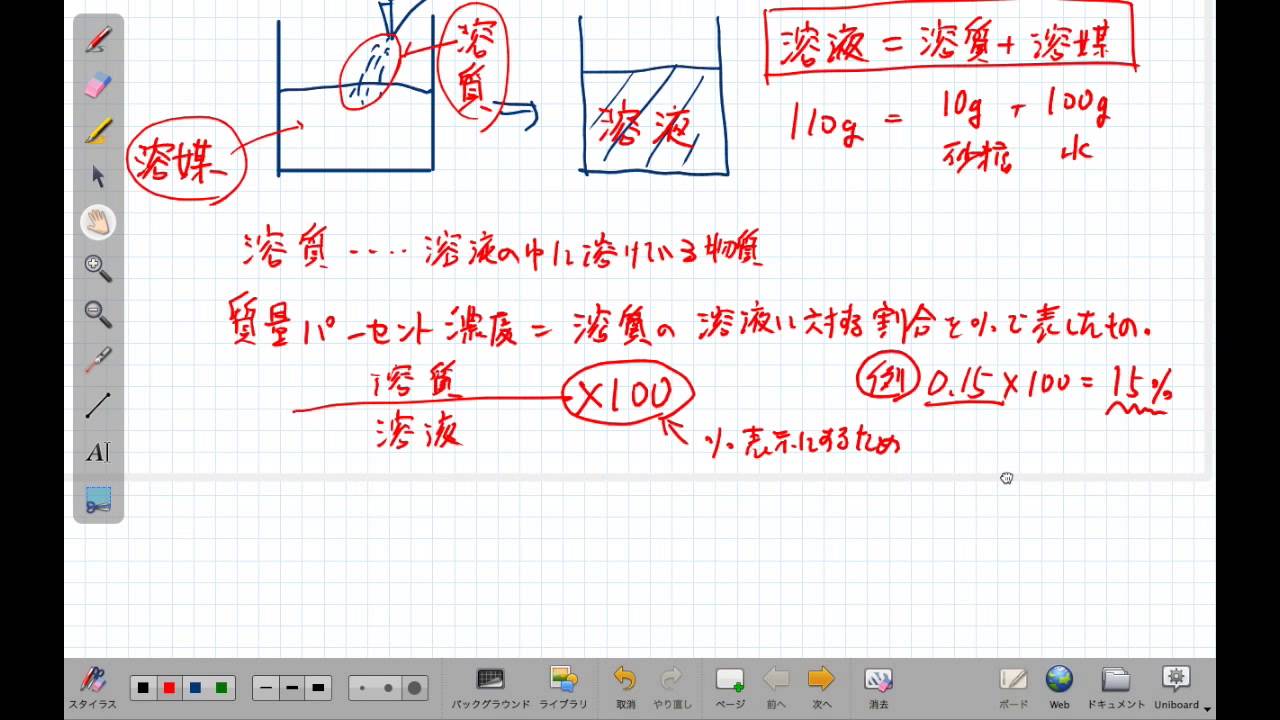
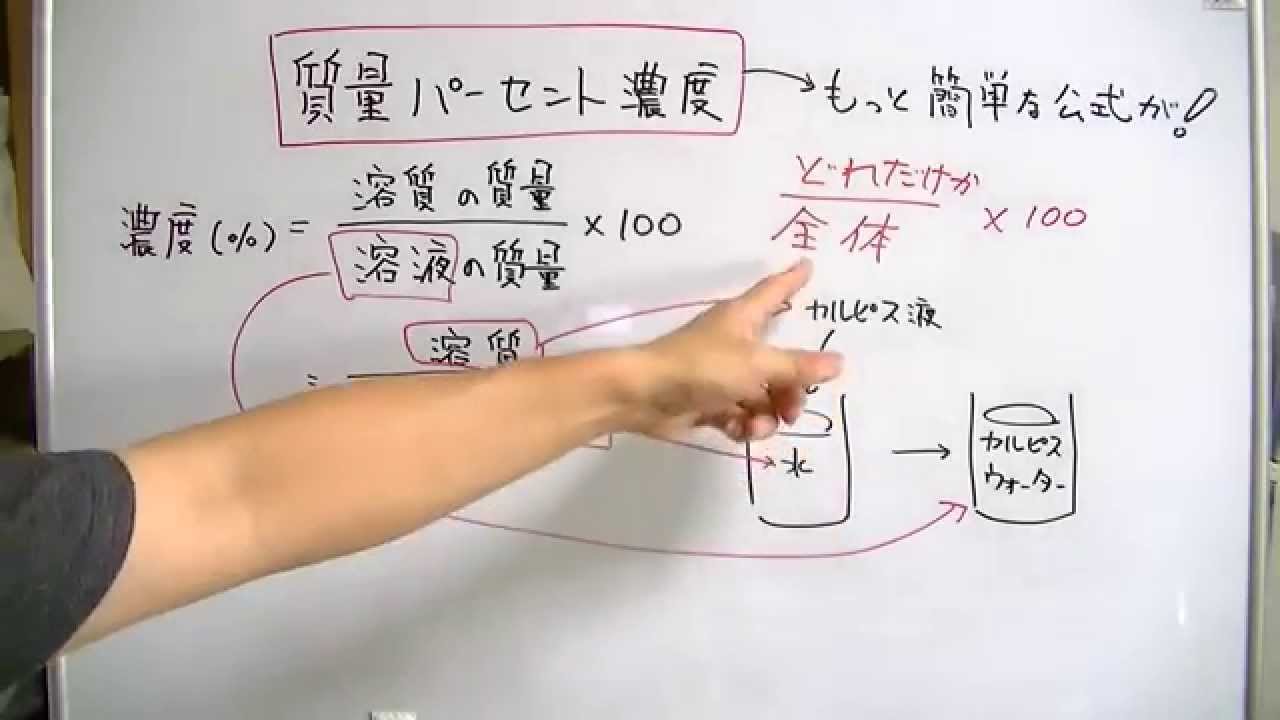
質量パーセント濃度の計算 質量パーセント濃度の計算を行う前に、濃度の求め方を復習しましょう。 質量パーセント濃度 = 溶質 / 溶液 ×100 質量パーセント濃度 = 溶質 /(溶媒 + 溶質) ×100 要するに、水溶液全体の質量に対し、溶けている溶質が何%なのかを求めているだけです。質量パーセント濃度 質量パーセント濃度 とは、その名の通り質量を使って求めた濃度です。 単位は%を使います。 溶液の質量に対して溶質が何g溶けているかを百分率で表したもの です。 次の計算式で求めることができます。濃度計算における基礎知識 溶液,溶質,溶媒とは? 濃度計算における解法のポイント 一般に,溶液中に含まれる溶質の割合を濃度といい,その表し方には,質量パーセント濃度,モル濃度, 質量モル濃度などがある。

高校理論化学 食酢中の酢酸のモル濃度と質量パーセント濃度 受験の月
質量 パーセント 濃度 計算
質量 パーセント 濃度 計算-溶質の質量を求める 水溶液の濃度の応用問題では、いつも真っ先に 「溶質は何gとけているだろう?」 「水溶液全体の質量は何gだろう?」 の2つを考えることができれば大丈夫です。濃度溶解度 チェックテスト 質量パーセント濃度を求めよ。(割り切れない場合小数第2位で四捨五入) 500gの水溶液の中に溶質が35g溶けている場合。 7% 300gの水溶液の中に溶質がg溶けている場合。 67% 水60gに溶質gを溶かした場合。 25% 水180gに溶質gを溶かした場合。



中1 理科 中1 32 質量パーセント濃度 Youtube
燐 質量パーセント濃度の基本計算 質量パーセント濃度を求めるには、 溶液1gあたりの溶質(g)を求める;濃度計算 質量パーセント濃度を求めよ。(割り切れない場合は小数第1位を四捨五入して整数で答えよ) 0gの水溶液の中に、溶質が30gが溶けている場合。 水460gに溶質40gを溶かした水溶液。質量パーセント濃度・モル濃度・質量モル濃度 の3つの濃度を習います。 多くの高校生が濃度計算でつまづくのは、 これらの定義をきちんと覚えられていないからです。 まずは濃度の定義を覚えていくのが第一段階ですね。
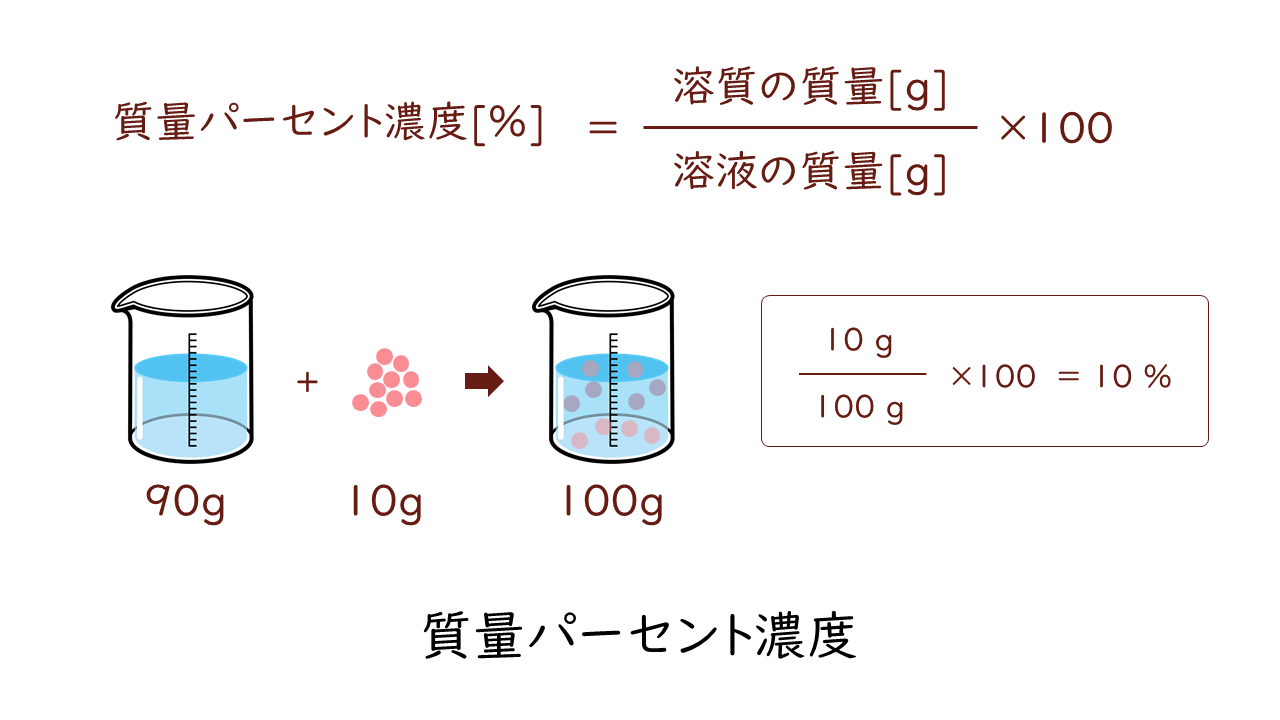
水酸化ナトリウムの質量パーセント濃度をモル濃度に変換します。 0 % 以上 522 % 以下の誤差(標準偏差)は ± mol/L です。 質量パーセント濃度濃度溶解度 チェックテスト 質量パーセント濃度を求めよ。(割り切れない場合小数第2位で四捨五入) 500gの水溶液の中に溶質が35g溶けている場合。 7% 300gの水溶液の中に溶質がg溶けている場合。 67% 水60gに溶質gを溶かした場合。 25% 水180gに溶質gを溶かした場合。質量パーセント濃度とは 次は"質量パーセント濃度"にうつりましょう。 単位:g/g→% $$\frac{溶質の質量(g)}{溶液の質量(g)}\times 100=\%$$ これも非常に単純で、溶液の質量(g)を分母、溶質の質量(g)を分子に持って来た上で「割合」を求めます。
水溶液の濃度 名前 溶液の濃さを、溶質の質量が全体の質量の何%にあたるかで表したものを 何というか。 次の問いに答えなさい。 ① 水 g に食塩 gをまぜると、何%の食塩水になるか。 ② 水 g に砂糖が gとけている。この砂糖水溶液の質量パーセント濃度31 質量パーセント濃度 100 gの溶液を考えたときに,そこに何gの溶質が溶けているかをパーセ ントであらわす方法が質量パーセント濃度である.質量パーセント濃度をあ らわす単位は%である*1.たとえば100 gの塩化ナトリウム水溶液があり,こ溶液には溶かした物質が同じものでも、濃度によってちがうものになります。 例えば、同じ塩水でも薄い塩水と濃い塩水がありますよね。 この溶液の濃さを表すときに使われるのが、重量パーセント濃度です。 重量パーセント濃度というのは、溶液全体の質量に対する溶液の質量の割合を



これでできる モル Mol 計算 化学基礎 最大の難所を突破しよう 化学 アイドル好きのホームページ



Learn De Leon 家庭教師 ランデレオン 理科 計算 公式 質量パーセント濃度 割合 Facebook
質量パーセント濃度とは 次は"質量パーセント濃度"にうつりましょう。 単位:g/g→% $$\frac{溶質の質量(g)}{溶液の質量(g)}\times 100=\%$$ これも非常に単純で、溶液の質量(g)を分母、溶質の質量(g)を分子に持って来た上で「割合」を求めます。では、実際に計算してみましょう。 溶液の質量は250gで、溶質の質量は50gです。 このことから、質量パーセント濃度は、次のようになります。 (50/250)×100=% よって、答えは、 「%」 となります。モル濃度・質量パーセント濃度・質量モル濃度!濃度計算の 演習問題 12/15/05 来週12/22に,以下の問題に類似したモルに関する小テストを行う. H = 10, C = 1, O = 160,Ca = 401 Cl = 355,P= 310, S = 3 とする. 問1 硫酸 00 mol は何 g か?



質量パーセント濃度 化学に関する質問 勉強質問サイト



Akiya Su 理科 質量パーセント濃度 溶質 溶媒 溶液と公式を覚えること 計算は難しくないが 割り算の筆算で小数点の位置がわからない人は先生に聞こう 中学理科 質量パーセント濃度
質量パーセント濃度の計算 質量パーセント濃度の計算を行う前に、濃度の求め方を復習しましょう。 質量パーセント濃度 = 溶質 / 溶液 ×100 質量パーセント濃度 = 溶質 /(溶媒 + 溶質) ×100 要するに、水溶液全体の質量に対し、溶けている溶質が何%なのかを求めているだけです。溶液には溶かした物質が同じものでも、濃度によってちがうものになります。 例えば、同じ塩水でも薄い塩水と濃い塩水がありますよね。 この溶液の濃さを表すときに使われるのが、重量パーセント濃度です。 重量パーセント濃度というのは、溶液全体の質量に対する溶液の質量の割合を溶液には溶かした物質が同じものでも、濃度によってちがうものになります。 例えば、同じ塩水でも薄い塩水と濃い塩水がありますよね。 この溶液の濃さを表すときに使われるのが、重量パーセント濃度です。 重量パーセント濃度というのは、溶液全体の質量に対する溶液の質量の割合を



中1 理科 中1 32 質量パーセント濃度 Youtube



7 8 9 2が分かりません 教えて下さい Clear
質量パーセント濃度の計算を苦手にしている人は多いですよね。 だけど、そんなに難しくない! 単純な計算をするだけでokなんですよ! ってことで、今回の記事を通して質量パーセント濃度の計算をマスターしていこうぜ★濃度計算 質量パーセント濃度を求めよ。(割り切れない場合は小数第1位を四捨五入して整数で答えよ) 0gの水溶液の中に、溶質が30gが溶けている場合。 水460gに溶質40gを溶かした水溶液。そして質量パーセント濃度の求め方というのは 「質量パーセント濃度(%) 溶質の質量(g) = ×100 溶液の質量(g) 溶質の質量(g) = ×100 溶質の質量(g)+溶媒の質量(g)」 の式で求めますなので溶け残りは計算しません。 わからない場合は



西村能一 科学の名著50冊が1冊でざっと学べる Kadokawa 化学計算問題 6 濃度 G Mol Lを求める 1 0 10 Mol L酢酸ch Cooh水溶液100 Mlに酢酸は何g溶けているか 2 3 0 Mol Lの塩酸 密度1 05g Cm の 質量パーセント濃度は何 か 3 12


Http Www Ajhs Ahs U Hyogo Ac Jp Nouka Pdf
ケン 「質量パーセント濃度は質量、モル濃度は粒子の個数。 ローザ 「 粒子を過不足無くきっちり反応させたいときはモル濃度を使う 、と覚え最初に触れましたが、質量パーセント濃度は以下の式で求められます。 質量パーセント濃度(%)= 溶質の質量(g)÷ 溶液(溶質溶媒)の質量(g)×100 これは、溶液の中に溶けている溶質が全体の何パーセントかということです。動画一覧や問題のプリントアウトはこちらをご利用ください。ホームページ → http//19chtv/ Twitter→ https//twittercom/haichi_toaru


実習21 水溶液の濃度 1年理科 化学 Takaの授業記録12



溶質 溶媒 溶液 塾の質問箱
(重量体積パーセントあるいは質量容積パーセントともいいます) これは溶液100ml中に溶質は何g入っていますか?というように 溶液の体積が決まっています。 質量体積パーセント 10%(w/v)の食塩水には 10gの食塩が入っていることになります。 では?質量パーセント濃度の求め方の計算公式って?? こんにちは!この記事を書いてるKenだよ。ペットボトル、固いね。 質量パーセント濃度の求め方の公式は、 (質量パーセント濃度 % )= (溶質の質量)÷(溶液の質量)×100 だ。



溶液中の溶質の濃度を示す 質量百分率濃度 を元研究員がわかりやすく解説 Study Z ドラゴン桜と学ぶwebマガジン


中1理科 数学 食塩水の問題を動画でマスター 公式の覚え方と濃度の計算 マナブレイン



モル濃度とは 計算 求め方 公式はコレで完璧 質量パーセントとの違いも 高校生向け受験応援メディア 受験のミカタ


中学1年理科 濃度 質量パーセント濃度 のポイント Examee


中1理科 身の回りの物質 質量パーセント濃度 Youtube



1 60 で水100gに硫酸銅 五水和物cuso 5h Oを30g溶解させた この溶液の質量パーセント濃度は何 か 硫酸銅 五水和物に関する問題 Youtube



高校理論化学 食酢中の酢酸のモル濃度と質量パーセント濃度 受験の月



この質量パーセントの計算を 教えてください ずっと考えてたんですけどこの公式の Clear


Schit Net Kasukabe Jhomashi Cabinets Cabinet Files Download 65 123dcbc6b7be0eefd055afb Frame Id 101



中学1年理科 質量パーセント濃度の計算演習問題 Examee



4番教えてください 計算の仕方がわからないです Clear


Keisetsu Net Column Images Sci Pdf



質量パーセント濃度 化学に関する質問 勉強質問サイト



モル濃度の計算 化学に関する質問 勉強質問サイト


壁紙 押入れ 50 溶液 の 質量 の 求め 方



美しい 水溶液 の 濃度 計算 壁紙 配布



4 6 溶液の濃度 おのれー Note



モル濃度とは 計算 求め方 公式はコレで完璧 質量パーセントとの違いも 高校生向け受験応援メディア 受験のミカタ


Http Www Chitakyoiku Ed Jp Ccm H21 Jhs 05rika Edtsc10g123suiyouekinoseisitu Pdf



ジュピターノート 108 モル濃度計算の仕方とパターンの解説 共通テスト 2次試験対 Clear



高校化学 質量と物質量 濃度の計算 オンライン無料塾 ターンナップ Youtube



化学基礎の質量パーセント濃度 化学に関する質問 勉強質問サイト


受験基礎化学 18 溶液の濃度 みかみの参考書ブログ



モノマナビ研究所



溶液の濃度に関する問題 完全攻略チャート 過去問解説集 自宅でできる受験対策ショップ ワカルー Wakaru



中1理科 濃度の計算 映像授業のtry It トライイット



高校生物基礎 腎臓のイヌリン濃縮率や原尿量などの計算問題の解き方 高校生物の学び舎



高校化学基礎 硫酸とモル濃度 映像授業のtry It トライイット



化学基礎 モル濃度と質量パーセント濃度の計算問題 Tekibo



高校理論化学 溶液の濃度と調製 質量パーセント濃度 密度とモル濃度の単位換算 受験の月



西村能一 科学の名著50冊が1冊でざっと学べる Kadokawa Twitterren 化学計算問題 31 鉛畜電池 鉛蓄電池に関して 次の問に答えよ 1 放電のとき 正極および負極で起こる変化を電子e を用いたイオン反応式で記せ 2 質量パーセント濃度30 の希硫酸1000gを
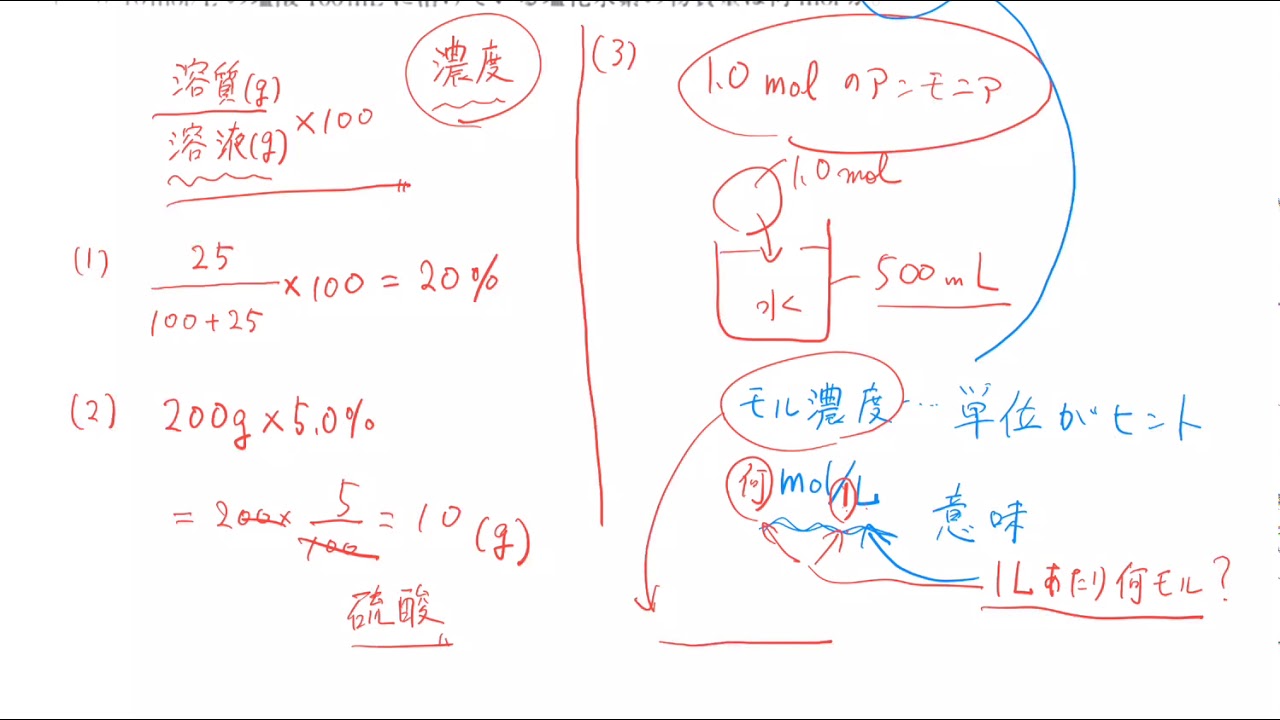


質量パーセント濃度とモル濃度の問題 Youtube



水溶液の計算 理科に関する質問 勉強質問サイト



4 6 溶液の濃度 おのれー Note
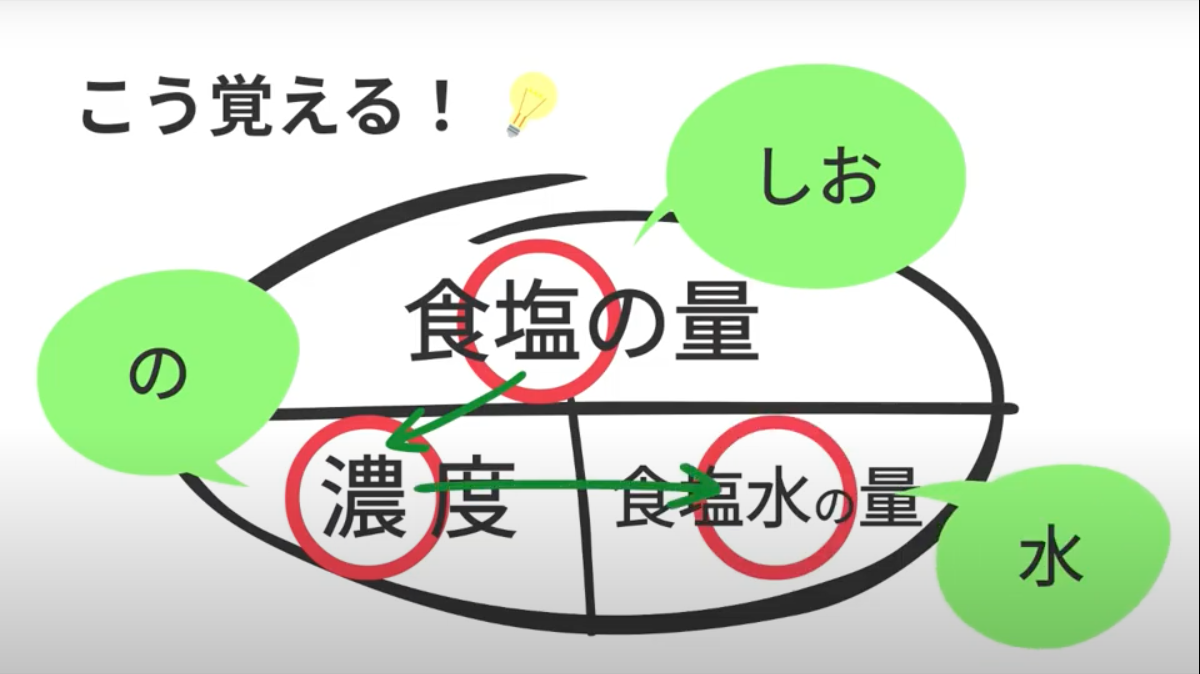


中1理科 数学 食塩水の問題を動画でマスター 公式の覚え方と濃度の計算 マナブレイン



濃度計算 化学に関する質問 勉強質問サイト



5問2 質量パーセント濃度 高校化学計算問題 Youtube
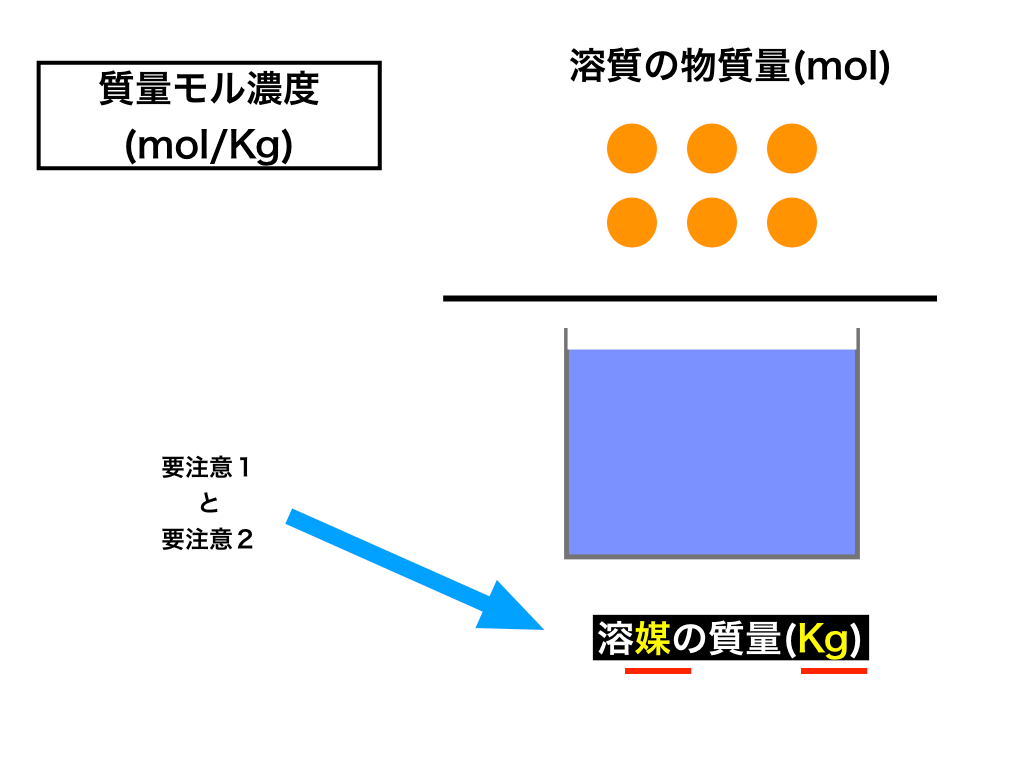


Mol濃度 質量パーセント濃度 質量モル濃度の相互変換の仕方のコツ



Akiya Su En Twitter 理科 質量パーセント濃度 溶質 溶媒 溶液と公式を覚えること 計算は難しくないが 割り算の筆算で小数点の位置がわからない人は先生に聞こう 中学理科 質量パーセント濃度



この問題の考え方を教えて欲しいです Clear



質量パーセント濃度 求め方 計算 高校化学 エンジョイケミストリー Youtube



質量パーセント濃度に関する質問 2ページ 勉強質問サイト


E School E Tokushima Or Jp Tokushima Jh Tomida Html Htdocs Index Php Action Common Download Main Upload Id 2411 Nc Session Tomida Jh Cfsg3gs49uk8c434g70nm6



鶴センセーの質量パーセント濃度 Youtube



中1 理科 質量パーセント濃度の計算 P塾


Http Www Ajhs Ahs U Hyogo Ac Jp Sui3 Pdf



ジュピターノート 108 モル濃度計算の仕方とパターンの解説 共通テスト 2次試験対 Clear



質量パーセント濃度



Hd限定理科 質量 パーセント 濃度 問題 ただぬりえ



高校化学基礎 モル濃度の計算 練習編 映像授業のtry It トライイット



理科 中1 27 質量パーセント濃度 Youtube



化学 硫黄160kgからの濃硫酸のℓ数 化学に関する質問 勉強質問サイト



モル濃度から質量パーセント濃度に変えることは可能ですか Clear



高校化学基礎 密度とモル濃度 映像授業のtry It トライイット



濃度 の計算が苦手な方へ 元研究員がわかりやすく解説 Study Z ドラゴン桜と学ぶwebマガジン



溶媒1kgの中に溶質が何mol溶けているかを示す 質量モル濃度 を元研究員が解説 Study Z ドラゴン桜と学ぶwebマガジン



危険物資格取得のための高校化学no 2 濃度計算 新たな学びをデザインする教育フリーランス


Http Www Asahikawa Med Ac Jp Dept Ge Chemical Rikai H26kangochem Pdf
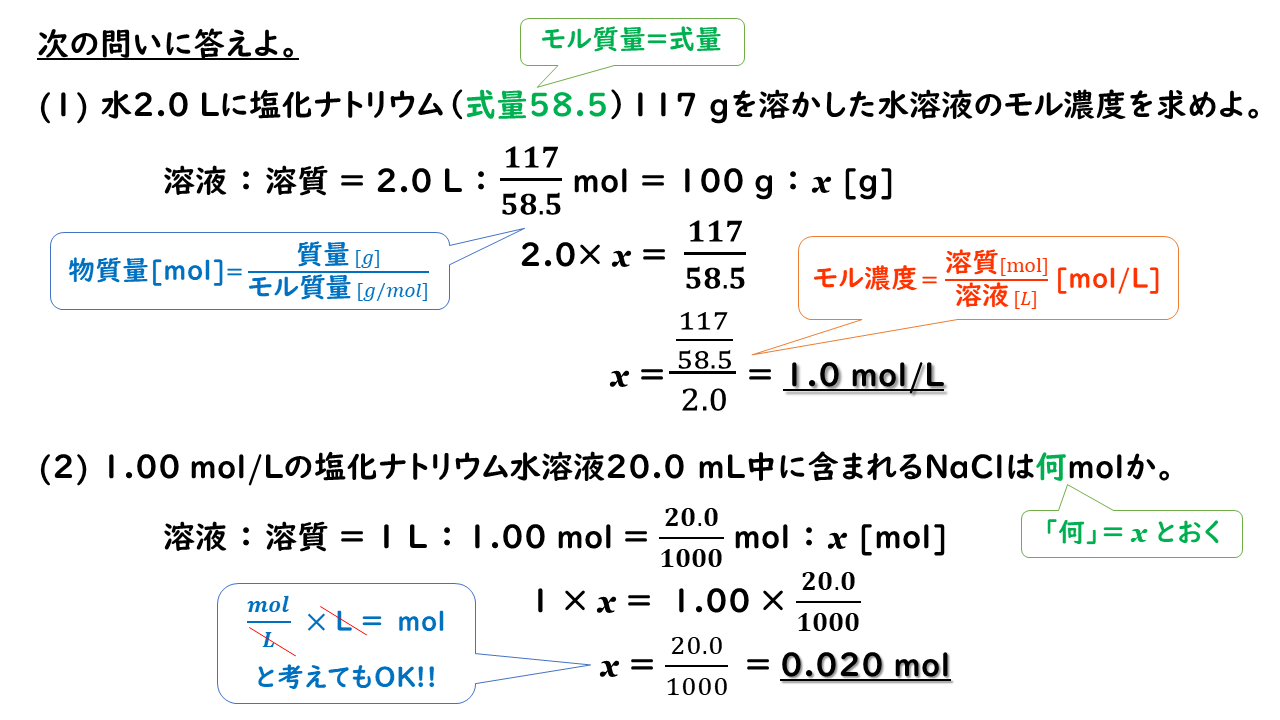


4 6 溶液の濃度 おのれー Note



4つの式と 教えてください 1番の答えは 2番の答えは 25 Clear



モル濃度から質量パーセント濃度に変えることは可能ですか Clear



質量パーセント濃度 塾の質問箱



どなたか教えていただきたいです Clear
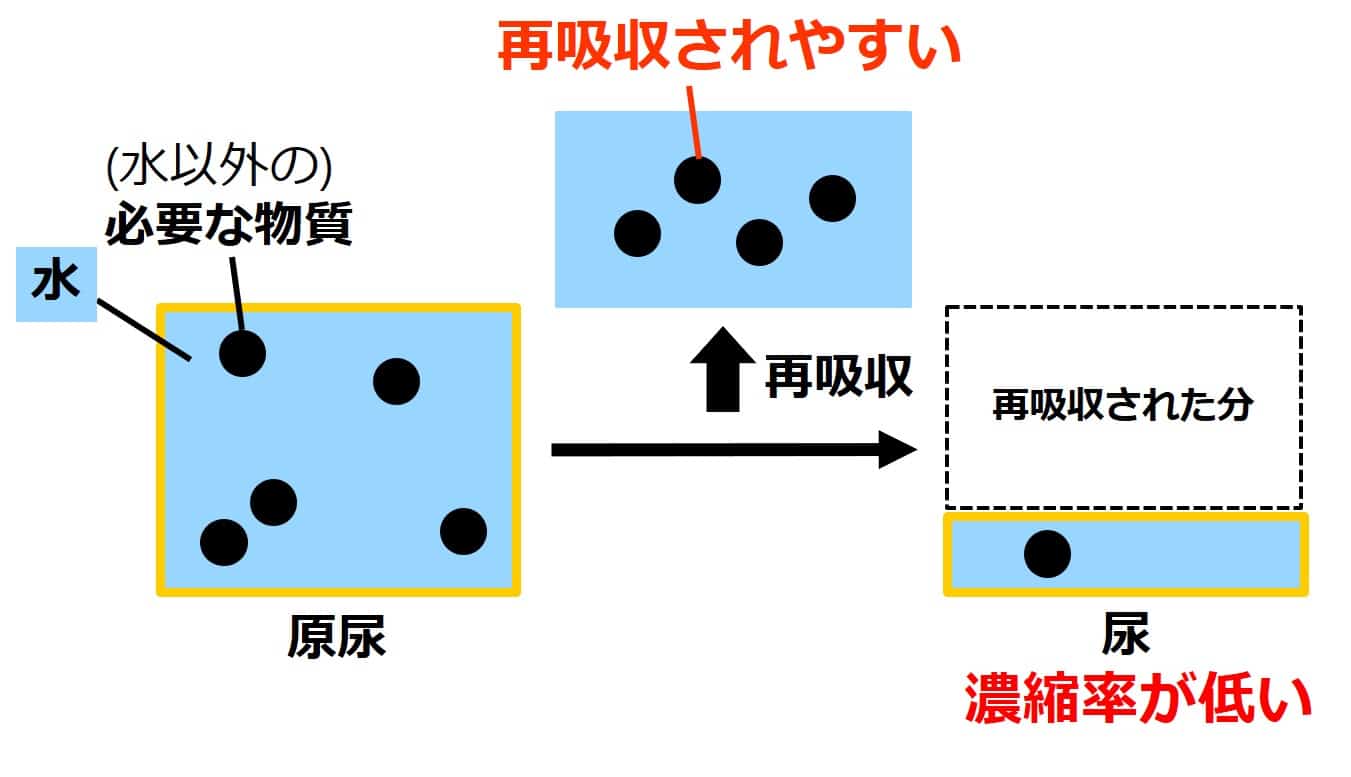


腎臓 計算に必要な基礎知識 濃縮率の求め方 せいぶつ農国



5分でわかる モル濃度 溶液1l中に溶質が何モル溶けている 元研究員がわかりやすく解説 Study Z ドラゴン桜と学ぶwebマガジン


2



濃度 の計算が苦手な方へ 元研究員がわかりやすく解説 ページ 3 4 Study Z ドラゴン桜と学ぶwebマガジン


Www Pref Saitama Lg Jp G23 Documents 30rika Pdf


溶液 濃度 気になる遺伝子



モル濃度とは 計算 求め方 公式はコレで完璧 質量パーセントとの違いも 高校生向け受験応援メディア 受験のミカタ


Www City Chiba Jp School Jhs 046 Documents Keisannpurinnto Pdf
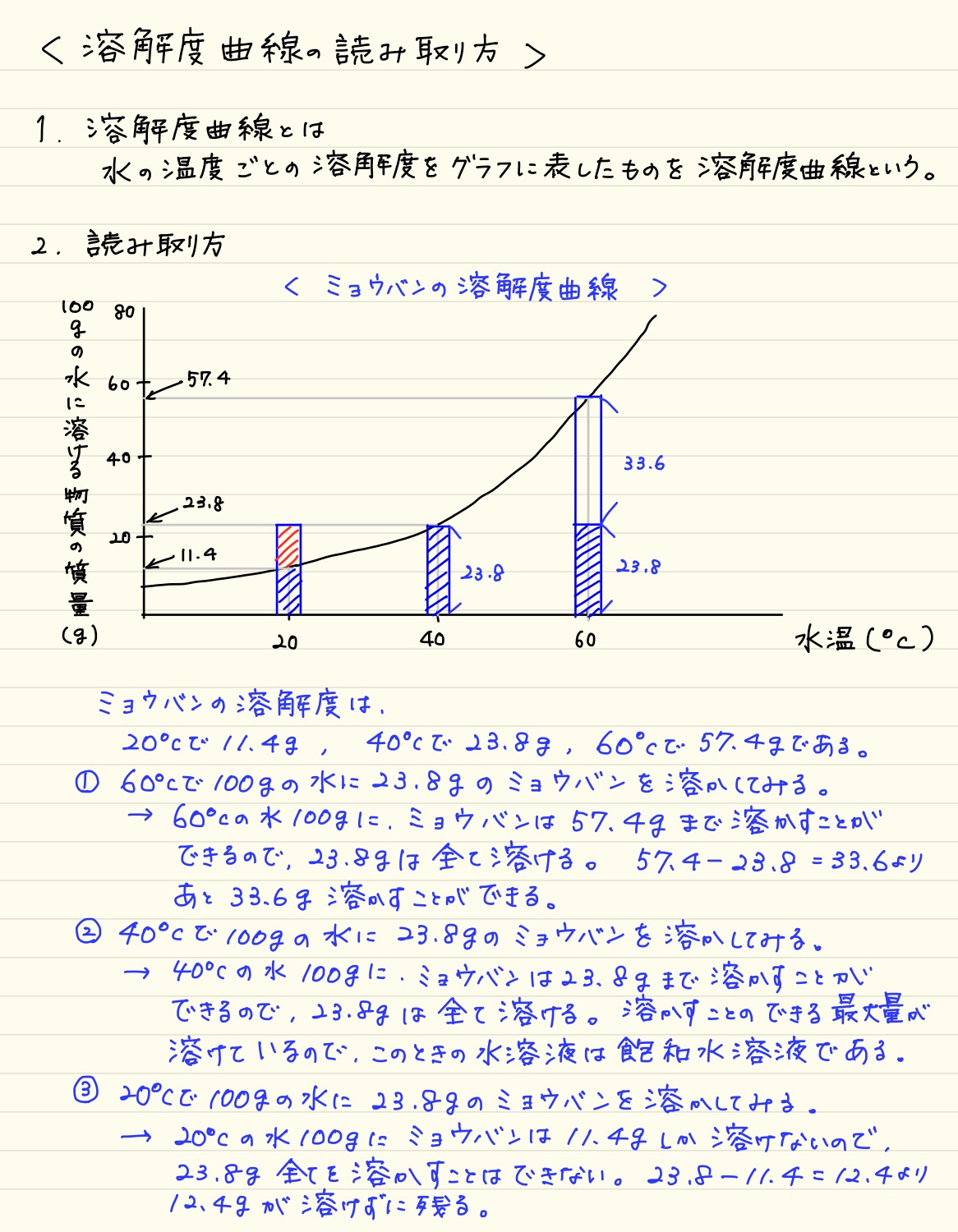


溶解度曲線の読み取り方 塾の質問箱



モル濃度の問題がとけません 化学に関する質問 勉強質問サイト



6 7 モル濃度と密度から質量パーセント濃度を計算します 1lあったとしたら と仮定すれば あとは簡単です プレテスト化学基礎 第3問 問3 Youtube



Learn De Leon 家庭教師 ランデレオン 理科 計算 公式 質量パーセント濃度 割合 Facebook



西村能一 科学の名著50冊が1冊でざっと学べる Kadokawa 化学計算問題 4 濃度 Mol L Mol Kgを求める 水酸化ナトリウム25gを水100gに溶解させた溶液の密度が1 2 G Cm3であった 1 この水溶液の質量パーセント濃度は何 か 2 この水溶液


Http Www Mie C Ed Jp Kenminundou Miesta H30 H30miesuta Kekkabunnsekihoukoku Tyuuri Pdf
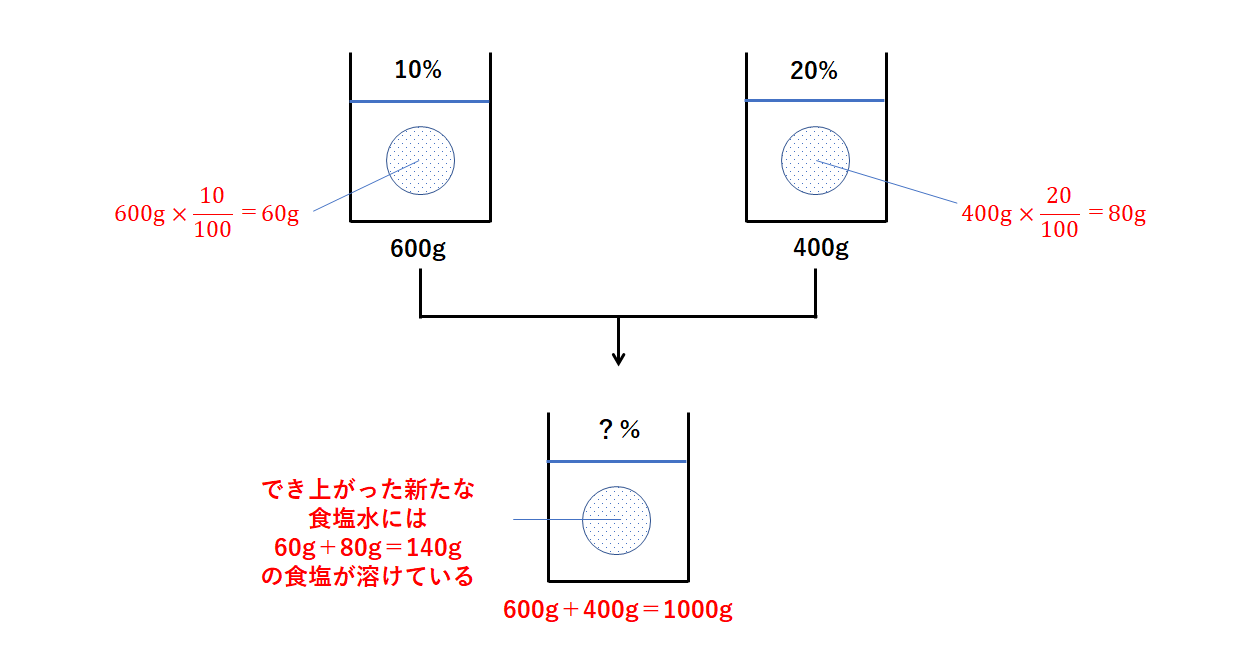


中1化学 水溶液 濃度 中学理科 ポイントまとめと整理



モル濃度について 密度の情報あり 化学に関する質問 勉強質問サイト



モル濃度 質量モル濃度 化学に関する質問 勉強質問サイト



Learn De Leon 家庭教師 ランデレオン 理科 計算 公式 質量パーセント濃度 割合 Facebook



高校化学 質量モル濃度 映像授業のtry It トライイット


Http School City Koshigaya Saitama Jp Hirakata J Attach Get2 367 0
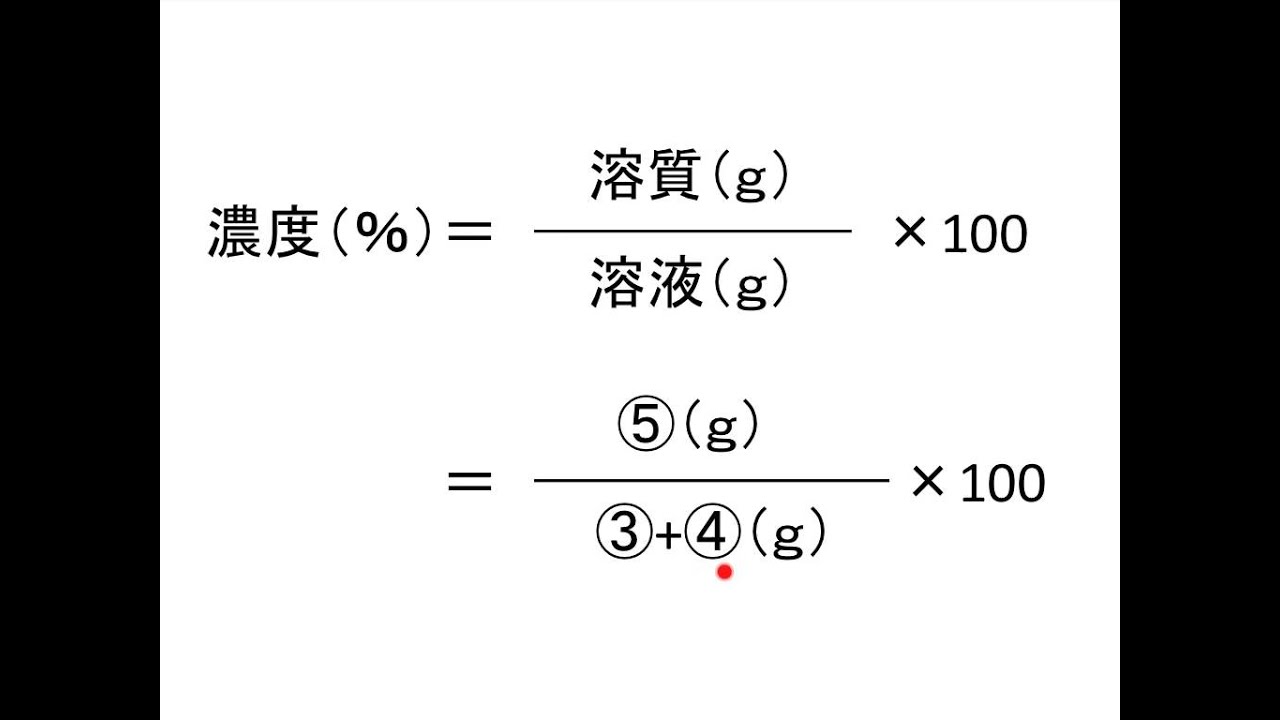


濃度の求め方 絵で覚えよう Youtube



ひどい 質量 パーセント 濃度 公式 壁紙 配布



中1理科 質量パーセント濃度の求め方 やすひこ先生の中学生授業log



質量パーセント濃度のやつだと思います 1 は15gで合ってますか 2 の解き方が分からないです 分かる方お願いします 高校数学に関する質問 勉強質問サイト


Http Fastliver Com Youekisample Pdf



化学 Mol 化学に関する質問 勉強質問サイト
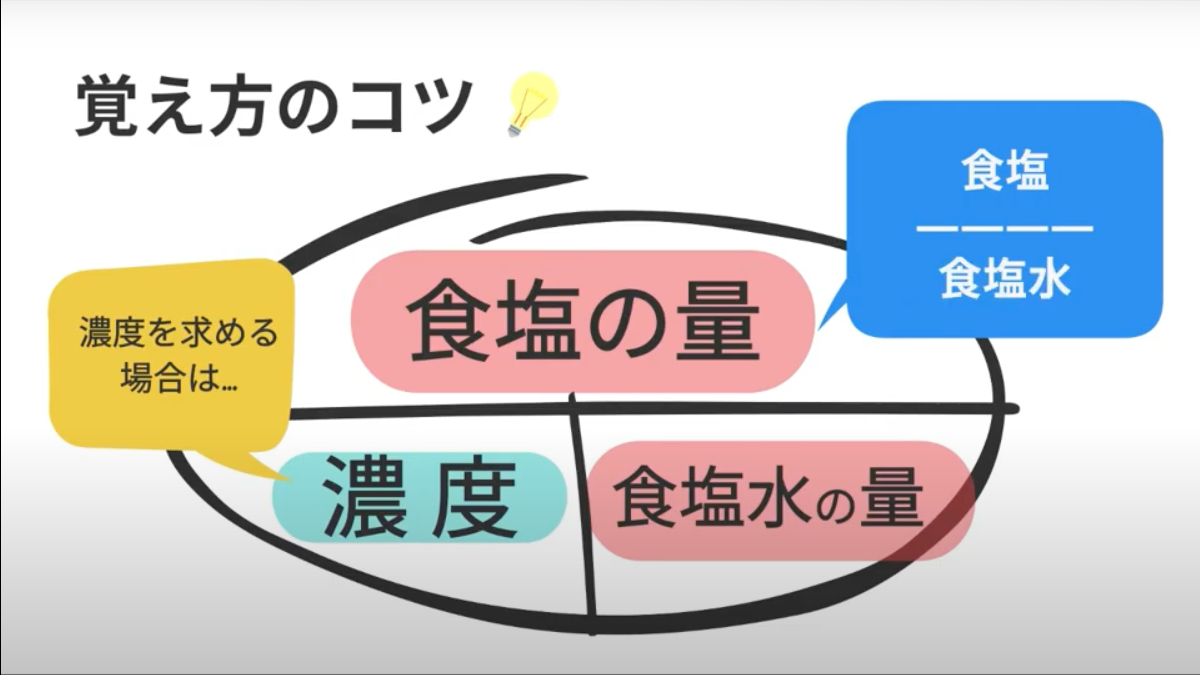


中1理科 数学 食塩水の問題を動画でマスター 公式の覚え方と濃度の計算 マナブレイン


